
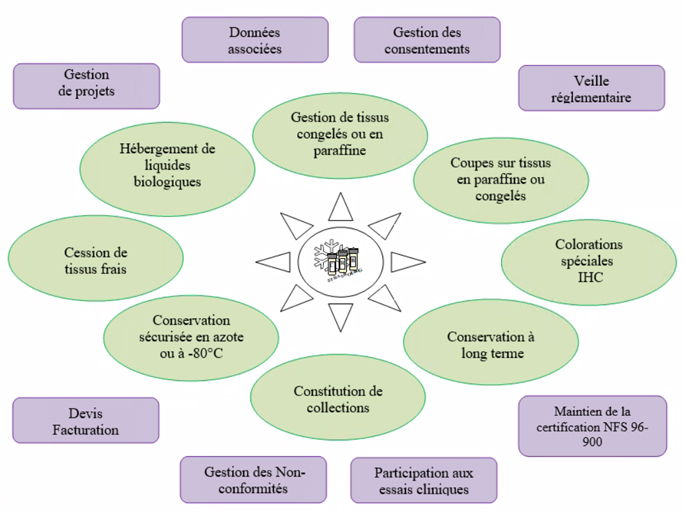
Banque d’échantillons biologiques congelés et/ou inclus en paraffine à visée de recherche dans le cadre de projets dûment évalués, avec transfert ou cession de matériel (brut ou produits dérivés) dont la traçabilité et la qualité sont assurées. Ce matériel est associé à des données cliniques, anatomopathologiques et/ou biologiques (items recommandés par l’Institut National du Cancer, INCa).
Création du CRB en 2002 suite à deux appels d’offres :
- AO INSERM 2002 « Collections de matériels biologiques d’origine humaine à des fins de recherche. Centre de Ressources Biologiques ».
- AO Ministère de la Santé 2001-2002 relatif au programme de soutien aux tumorothèques hospitalières.
Centre de ressources biologiques
UF 6337 – Département de Pathologie
CHU de Hautepierre
03 88 12 84 11 / Fax : 03 88 12 89 90
CRB@CHRU-STRASBOURG.FR
horaires d’Ouverture : 9h – 16h
pour la congélation de prélèvements et les protocoles en cours, l’astreinte peut être prolongée jusqu’à 17h si le CRB est averti avant 16h.
Comment ça marche ?
- régi par une Charte à laquelle adhérent les référents des différentes collections d’échantillons biologiques
- soumission d’un projet avec mise à disposition de ressources biologiques déjà conservées (remplir la demande de projet et la renvoyer par email à crb@chru-strasbourg.fr) ou avec initiation d’un nouvelle collection (contacter la Direction de la Recherche Clinique et des Innovations)
- information et consentement du patient
- transfert ou cession des ressources biologiques
- retour d’information sur l’utilisation des ressources biologiques
- citations/remerciements du CRB dans les publications
L’équipe du CRB
Tarification
Le coût de l’utilisation des ressources biologiques doit être intégré dans les demandes de financement des projets de recherche.
Evaluation au niveau national du coût d’un échantillon tissulaire congelé hautement qualifié (Institut National du Cancer et DGOS) : 70 à 300 € par échantillon.
Démarche qualité et enjeux
Le CRB a mis en place une démarche qualité afin que l’ensemble de ses activités réponde de manière appropriée et efficace aux besoins, attentes et exigences des différentes parties intéressées du CRB, dont les patients, les prescripteurs et les chercheurs.
Grâce à un important travail fourni par une équipe soudée et engagée toute entière dans une démarche qualité, le CRB est certifié depuis novembre 2010. Cette certification selon la norme NF S 96-900 – « Qualité des ressources biologiques (CRB) – Système de management d’un CRB et qualité des ressources biologiques » – favorise l’harmonisation des pratiques professionnelles des Centres de Ressources Biologiques.
Son application est compatible avec les exigences de l’ISO 9001 et les 4 recommandations métiers de l’Organisation de Coopération et de Développement Economiques (OCDE) :
- la rigueur scientifique : pour garantir l’origine et la qualité des ressources biologiques,
- la sécurité : pour contrôler l’émergence de nouvelles collections,
- l’exigence éthique (prise en compte du cadre législatif existant),
- la régulation économique, avec la mise en place de règles précises d’accès aux collections.
L’utilisation de la qualité comme outil de management a permis :
- de piloter le système avec une grande efficacité
- de perfectionner la traçabilité et la reproductibilité des pratiques
- d’optimiser et de valoriser les activités du CRB
- d’assurer la cohésion de l’équipe
Le catalogue
Le CRB conserve des échantillons biologiques de pathologies cancéreuses, non cancéreuses et de tissus sains.
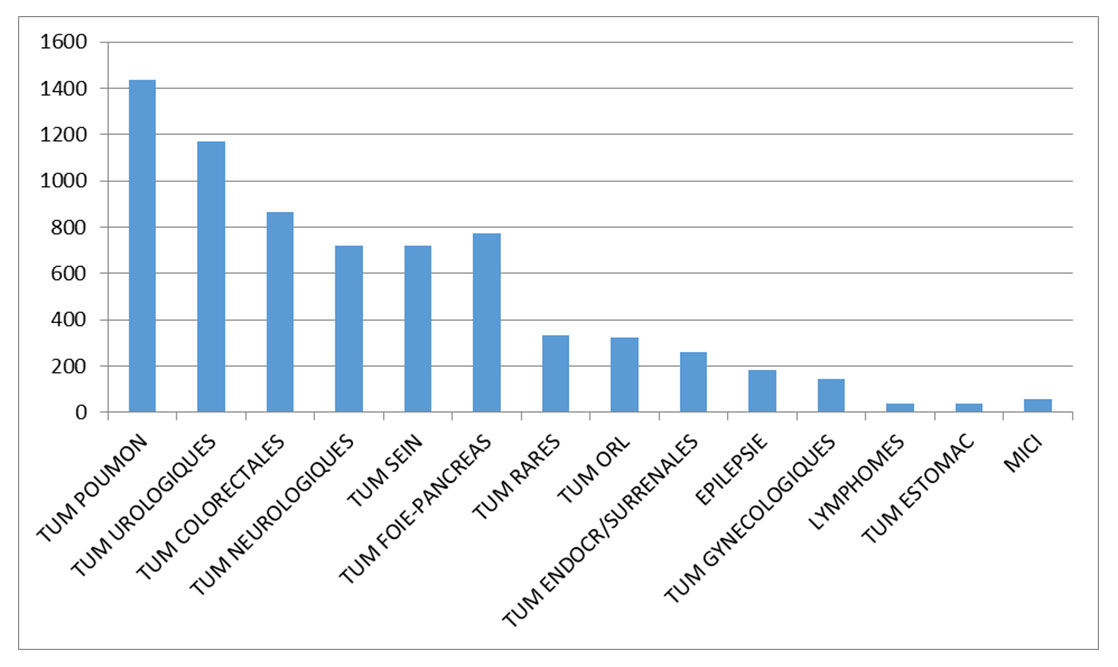
Répartition des collections de prélèvements tissulaires congelés avec consentement*
* Données à titre indicatif au 6/12/2024 : 7041 prélèvements avec consentement sur 10 098 prélèvements congelés (hors tumorothèque sanitaire). Des données plus précises peuvent être fournies à la demande pour chaque collection.
Informations en consentement du patient
L’utilisation des échantillons d’un patient à une fin médicale ou scientifique autre que celle pour lesquels ils ont été prélevés nécessite au préalable que le patient ait été informé de cette autre fin, ne s’y soit pas opposé (art. 1211-2 du code de la santé publique), et si cette utilisation implique l’examen de caractéristiques génétiques du patient, qu’il ait donné son accord écrit (art. 16-10 du code civil).
Afin de respecter ces dispositions légales et de faciliter le travail des médecins en charge du recueil du consentement des patients, le C.R.B. met à leur disposition un système d’information approuvé par le C.P.P. Est IV et basé sur deux documents, concernant uniquement les patients adultes :
- une notice d’information que le médecin remet au patient en lui apportant les explications nécessaires.
- un formulaire de consentement à compléter et à signer par le patient et par le médecin, en trois exemplaires (un à conserver par le patient, le second à conserver dans le dossier médical du patient, le troisième à remettre au C.R.B.).
Patients mineurs
- une notice d’information à remettre aux titulaires de l’autorité parentale
- une notice d’information simplifiée destinée à l’enfant s’il est en âge de comprendre
- un formulaire de consentement à compléter et à signer en trois exemplaires par TOUS les titulaires de l’autorité parentale, par le médecin, et par le patient mineur s’il est apte à exprimer sa volonté.
Patients sous tutelle
- une notice d’information à remettre au tuteur légal
- un formulaire de consentement à compléter et à signer en trois exemplaires par le tuteur légal, par le médecin, et par le patient sous tutelle s’il est apte à exprimer sa volonté.
Pour les médecins qui le souhaitent, des triplicates du formulaire de consentement peuvent être fournis par le C.R.B. sur simple demande (crb@chru-strasbourg.fr ).
Mis à jour le 10/12/2024

